
「5歳未満又は体重15kg未満のホモ接合体家族性高コレステロール血症患者」における治療薬としても評価され2024年5月に添付文書を改訂しました。
有効性
ベースラインから投与24週後のLDL-Cの変化率[平均値(95%CI)]は、エヴキーザ<パートB>群-48.3%(-68.8, -27.8)でした。
有効性
成人及び青年HoFH患者(12歳以上)を対象とした国際共同
第Ⅲ相試験(R1500-CL-1629試験、65例のうち日本人10例)
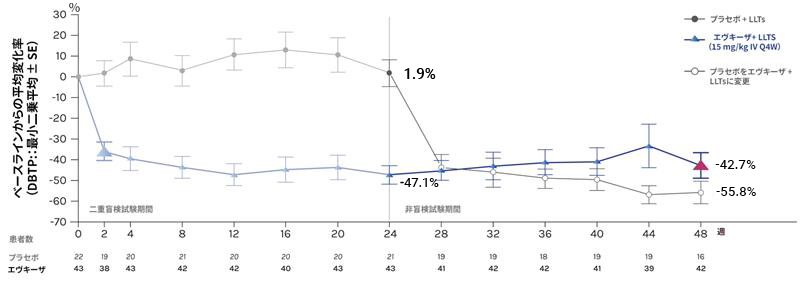
における、二重盲検投与完了後、すべての患者を非盲検投与期間に移行した、24週目から48週目までのLDLコレステロールの変化率
1
- 第24週まで
- 第48週まで
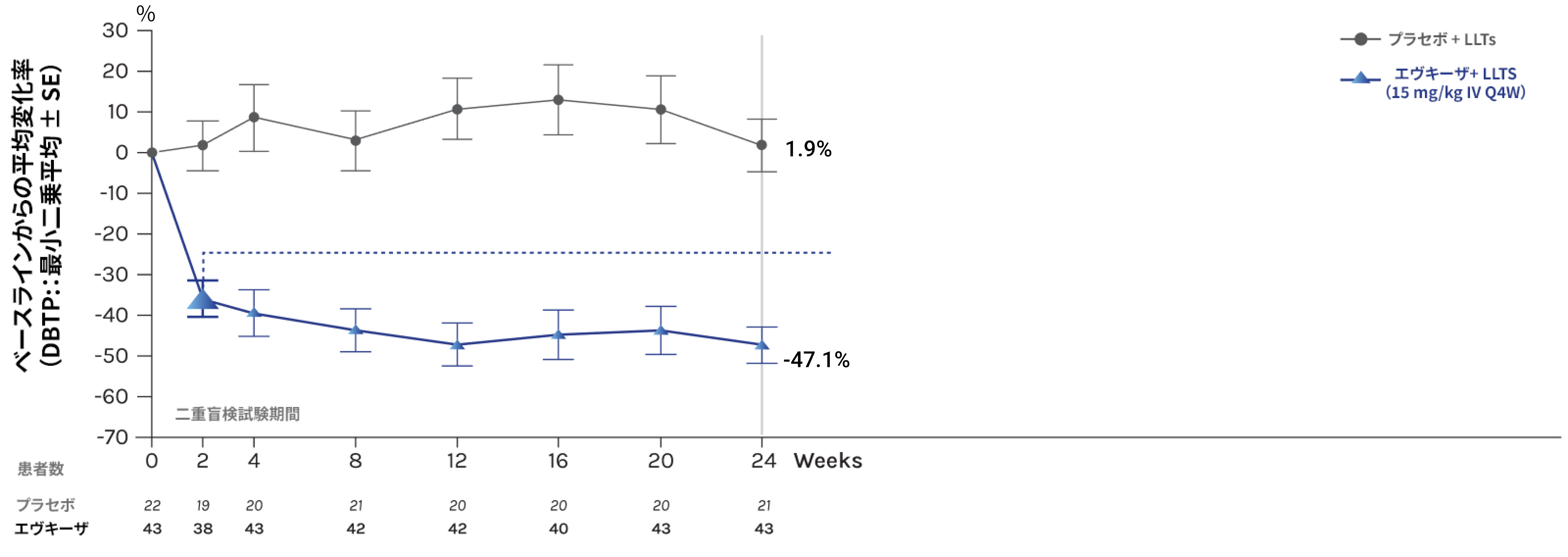
ベースラインから投与24週後のLDL-Cの変化率 (検証的試験結果) <主要評価項目>
ベースラインから投与24週後のLDL-Cの変化率(LS平均値)は、エヴキーザ群-47.1%、プラセボ群1.9%で、LS平均値の群間差(95%CI)は、-49.0%(-65.0, -33.1)であった。エヴキーザ群では、プラセボ群と比較して統計的に有意なLDL-Cの低下が検証された(p<0.0001、MMRM)
(絶対変化量 -約130 mg/dL、最小二乗平均、95% CI:-65% から -33%、n=65、P<0.0001)
LDL-コレステロールの減少は、48週目までは以下の通りでした
| 目 的 | HoFH患者におけるエヴキーザの有効性及び安全性をプラセボと比較して評価する。 | ||||
|---|---|---|---|---|---|
| 試験デザイン | 多施設共同、二重盲検、無作為化、プラセボ対照、並行群間比較試験 | ||||
| 対 象 | 成人及び青年HoFH患者(12歳以上)65例(日本人10例を含む) | ||||
| 方 法 | 本試験は、24週間の二重盲検投与期間と24週間の非盲検投与期間で構成された。 患者は、過去に不耐又は効果不十分等があった場合を除いて、基礎治療として他の脂質低下療法[スタチン 最大耐用量、エゼチミブ、PCSK9阻害薬{エボロクマブ又はアリロクマブ(国内販売停止)}、ロミタピド、 LDLアフェレシス等]を併用した。 ※HMG-CoA還元酵素阻害剤は「スタチン」として記載した。(以下、スタチン) | ||||
出典:Raal et al. JACC: ADVANCES, VOL. 2, NO. 9, 2023
※二重盲検試験期間終了後、無作為に選ばれた患者65人中、非盲検試験期間に入った64人の患者にエビナクマブが投与されました。
LDLコレステロールの減少は、検討された基礎療法において以下の通りでした2
| ベースライン時の基礎療法 | ベースライン時に基礎療法なし | |||
|---|---|---|---|---|
| ベースライン時の基礎療法、平均(SD) | エヴキーザ15 mg/kg IV Q4W、% (SD)† | プラセボ IV Q4W、% (SD)† | エヴキーザ15 mg/kg IV Q4W、% (SD)† | プラセボ IV Q4W、% (SD)† |
| スタチン | -47% (31), N=61 | 2% (32), N=61 | -46% (11), N=4 | -6% (23), N=4 |
| エゼチミブ | -53% (21), N=49 | -2% (31), N=49 | -28% (46), N=16 | 12% (34), N=16 |
| ロミタピド | -50% (23), N=14 | -17% (48), N=14 | -46% (32), N=51 | 5% (28), N=51 |
| PCSK9阻害薬 | -50% (32), N=50 | 2% (30), N=50 | -39% (20), N=15 | 1% (36), N=15 |
| アフェレシス | -46% (18), N=22 | -7% (34), N=22 | -48% (34), N=43 | 7% (29), N=43 |
引用(Raal FJ, Rosenson RS, Reeskamp LF, et al. Evinacumab for homozygous familial hypercholesterolemia.N Engl J Med.2020;383(8):711-720 )を一部改変
※エヴキーザ群の患者さんのうち69.8%は少なくとも3種類以上のLLTを受けていました。2

安全性プロファイル
臨床試験で検討されたエヴキーザの
安全性プロファイル
<二重盲検投与期間>
二重盲検投与期間において、有害事象が1件以上発現した患者は、エヴキーザ群で44例中29例 (65.9%)、プラセボ群で21例中17例 (81.0%) であった (SAF)
<非盲検投与期間>
非盲検投与期間において、有害事象が1件以上発現した患者は、全体集団で64例中47例 (73.4%) であった (SAF)
※アナフィラキシー、注入部位そう痒感を含むinfusion reactionがあらわれることがあるので、異常が認められた場合には、注入速度の減速、投与の中断又は中止し、適切な処置を行ってください。
<二重盲検投与期間>
二重盲検投与期間において、有害事象が1件以上発現した患者は、エヴキーザ群で44例中29例(65.9%)、プラセボ群で21例中17例(81.0%)であった(SAF)。主な有害事象(発現率5%以上)は、エヴキーザ群では、上咽頭炎[7例(15.9%)]、インフルエンザ様疾患[5例(11.4%)]、頭痛[4例(9.1%)]、鼻漏[3例(6.8%)]であり、プラセボ 群では、上咽頭炎、頭痛[各5例(23.8%)]、歯痛、尿路感染、AST増加、筋肉痛[各2例(9.5%)]であった。重篤な有害事象が発現した患者は、エヴキーザ群で2例(4.5%)であり、尿路性敗血症、自殺企図が各1例(2.3%)に認められた。これらの有害事象は、いずれも治験担当医師がエヴキーザとの関連があると判断した有害事象ではなかった。
本試験では有害事象により治験薬の投与中止に至った患者はいなかった。死亡例はなかった。
<非盲検投与期間>
非盲検投与期間において、有害事象が1件以上発現した患者は、全体集団で64例中47例(73.4%)であった(SAF)。主な有害事象(発現率5%以上)は、上咽頭炎、頭痛[各6例(9.4%)]であった。重篤な有害事象が発現した患者は7例(10.9%)であり、狭心症、不安定狭心症、うっ血性心不全、冠動脈疾患、頸動脈再狭窄、腎盂腎炎/ 腎石灰沈着症、急性心筋梗塞/心臓処置合併症/大動脈狭窄が各1例(1.6%)に認められた。これらの有害事象は、いずれも治験担当医師がエヴキーザとの関連があると判断した有害事象ではなかった。
本試験では有害事象により治験薬の投与中止に至った患者はいなかったa。死亡例はなかった。
a:1例が妊娠のため治験薬の投与中止に至ったが、本試験では、妊娠を試験治療下で発現した有害事象とみなさなかった。

安全性プロファイル
臨床試験で検討されたエヴキーザの
安全性プロファイル
有害事象が1件以上発現した患者は、全体集団で64例中47例でした(SAF)
※アナフィラキシー、注入部位そう痒感を含むinfusion reactionがあらわれることがあるので、異常が認められた場合には、注入速度の減速、投与の中断又は中止し、適切な処置を行ってください。
<安全性>
【二重盲検投与期間】
有害事象が1件以上発現した患者は、本剤群で44例中29例(65.9%)、プラセボ群で21例中17例(81.0%)であった(SAF)。主な有害事象(発現率5%以上)は、本剤群では、上咽頭炎7例(15.9%)、インフルエンザ様疾患5例(11.4%)、頭痛4例(9.1%)、鼻漏3例(6.8%)であり、プラセボ群では、上咽頭炎、頭痛各5例(23.8%)、歯痛、尿路感染、AST増加、筋肉痛各2例(9.5%)であった。重篤な有害事象が発現した患者は、本剤群で2例(4.5%)であり、尿路性敗血症、自殺企図が各1例(2.3%)に認められた。これらの有害事象は、いずれも治験担当医師が本剤との関連があると判断した有害事象ではなかった。本試験では有害事象により治験薬の投与中止に至った患者及び死亡例はいなかった。
【非盲検投与期間】 有害事象が1件以上発現した患者は、全体集団で64例中47例(73.4%)であった(SAF)。主な有害事象(発現率5%以上)は、上咽頭炎、頭痛各6例(9.4%)であった。重篤な有害事象が発現した患者は7例(10.9%)であり、狭心症、不安定狭心症、うっ血性心不全、冠動脈疾患、頸動脈再狭窄、腎盂腎炎/腎石灰沈着症、急性心筋梗塞/心臓処置合併症/大動脈狭窄が各1例(1.6%)に認められた。これらの有害事象は、いずれも治験担当医師が本剤との関連があると判断した有害事象ではなかった。本試験では有害事象により治験薬の投与中止に至った患者a及び死亡例はいなかった。
a:1例が妊娠のため治験薬の投与中止に至ったが、本試験では、妊娠を試験治療下で発現した有害事象とみなさなかった。
目的 :小児HoFH患者におけるエヴキーザの長期安全性、有効性及び薬物動態を評価する。
試験デザイン :多施設共同、3パート、単群、非盲検試験
対象 :小児HoFH患者(5歳以上11歳以下)20例
<パートA>6例、<パートB>14例、<パートC>20例
方法 :本試験は、エヴキーザ単回投与後の薬物動態を評価するパートA、24週間の非盲検投与期間を有するパートB、パートA及びパートBの継続投与試験で48週間の非盲検投与期間を有するパートCの3パートで構成された。患者は基礎治療として他の脂質低下療法[スタチン最大耐用量、エゼチミブ、PCSK9阻害薬{エボロクマブ又はアリロクマブ(国内販売停止)}、ロミタピド、LDLアフェレシス等]を併用した。
<パートA> 非盲検下でエヴキーザ15mg/kgを単回静脈内投与した(エヴキーザ パートA群)。パートAの完了後、患者はパートCに移行して継続投与を受けるか選択可能とした。
<パートB> 非盲検下でエヴキーザ15mg/kgを4週に1回、24週間静脈内投与した(エヴキーザ パートB群)。パートBの完了後、患者はパートCに移行して継続投与を受けるか選択可能とした。
<パートC> パートA又はパートB完了後、本パートに移行した患者に、非盲検下でエヴキーザ15mg/kgを4週に1回、48週間静脈内投与した(エヴキーザ パートC群)。
5~11歳の小児患者における、
24週目までのベースラインからのLDLコレステロール変化率
<有効性評価項目(パートBの主要評価項目:検証的な解析項目)>

引用:
Wiegman et al.(一部改変) 主要評価項目。
主要有効性評価時点(24週目)でデータが
欠落しているため、生データを示します。
LDLコレステロールの低下効果:
- アフェレシスの有無やHoFHの遺伝子変異型についてネガティブ/ネガティブ変異の有無にかかわらず、エヴキーザの有効性が示唆された
- LDLRが陰性/陰性であっても変化なし

安全性プロファイル
臨床試験で検討されたエヴキーザの
安全性プロファイル
<パートA>
データカットオフ日時点(2021年2月11日)までに、有害事象が1件以上発現した患者(SAF)は、エヴキーザ <パートA>群で6例中5例(83.3%)であった。
<パートBとパートCの併合集団a>
データカットオフ日時点(パートB:2022年1月31日、パートC:2022年6月2日)までに、有害事象が1件以上 発現した患者(SAF)は、併合集団で20例中19例(95.0%)であった。
※アナフィラキシーを含む過敏性や注入反応(そう痒症)が報告されています。 症状が出た場合は治療を中止し、一般的な治療方法に従ってください。
<パートA>
データカットオフ日時点(2021年2月11日)までに、有害事象が1件以上発現した患者(SAF)は、エヴキーザ <パートA>群で6例中5例(83.3%)であった。主な有害事象(2例以上に発現)は、ビタミンD欠乏、咳嗽、口腔 咽頭痛、アレルギー性鼻炎[各2例(33.3%)]であった。 パートAにおいて、重篤な有害事象が発現した患者、有害事象により治験薬の投与中止に至った患者はいなかった。 死亡例はなかった。
<パートBとパートCの併合集団a >
データカットオフ日時点(パートB:2022年1月31日、パートC:2022年6月2日)までに、有害事象が1件以上 発現した患者(SAF)は、併合集団で20例中19例(95.0%)であった。主な有害事象(4例以上に発現)はCOVID-19 [15例(75.0%)]、発熱[5例(25.0%)]、頭痛、口腔咽頭痛[各4例(20.0%)]であった。 重篤な有害事象が発現した患者は1例(5.0%)であり、扁桃炎が1例(5.0%)に認められた。この有害事象は、治験 担当医師がエヴキーザとの関連があると判断した有害事象ではなかった。 パートBとパートCの併合集団において、有害事象により治験薬の投与中止に至った患者はいなかった。死亡例は なかった。
a:パートBとパートCの併合データの結果は累積的に報告し、パートAからパートCに移行した患者についてはパートC参加時のデータのみ、パートBからパートC に移行した患者についてはパートB及びパートC参加時のデータを含めた。
LDLコレステロール=低比重リポタンパク質コレステロール
LS=最小二乗
CI=信頼区間
DBTP=二重盲検試験期間
SE=標準誤差
Q4W=4週間ごと
SD=標準偏差
PCSK9=ヒトプロタンパク質転換酵素サブチリシン/ケキシン9型
LLT=脂質低下療法
LDLR= LDL受容体
参照:
- エヴキーザ®点滴静注液345mg 総合製品情報概要 2024年5月作成
- Raal FJ, Rosenson RS, Reeskamp LF, et al. Evinacumab for homozygous familial hypercholesterolemia.N Engl J Med.2020;383(8):711-720, This study was sponsored by Regeneron Pharmaceuticals, Inc
- Wiegman A, et al. Circulation. 2024;149:343–353 This study was sponsored by Regeneron Pharmaceuticals, Inc.
Ultragenyx Japan株式会社は、生後6カ月以上5歳未満のホモ接合体家族性高コレステロール血症(HoFH)患者に本剤15mg/kgを4週に1回反復静脈内投与したときの曝露量及び薬力学的作用を、5歳以上のHoFH患者の臨床データを用いて構築した母集団薬物動態解析及び母集団薬物動態/薬力学解析により推定しました。その結果、生後6ヵ月以上5歳未満のHoFH患者の定常状態における曝露量は、概ね5歳以上のHoFH患者で観察された範囲内であり、ベースラインからのLDL-Cの低下の程度は、5歳以上のHoFH患者と大きく異ならないと推定されたことから、HoFH治療薬「エヴキーザ点滴静注液345mg」<一般名:エビナクマブ(遺伝子組換え)>の添付文書の5歳未満又は体重15kg未満のホモ接合体家族性高コレステロール血症患者における使用についての記載を、2024年5月に改訂しました。
※効能又は効果、用法用量及び警告・禁忌を含む注意事項等については電子化された添付文書をご覧ください。

